Spezifische Verdampfungswärme berechnen
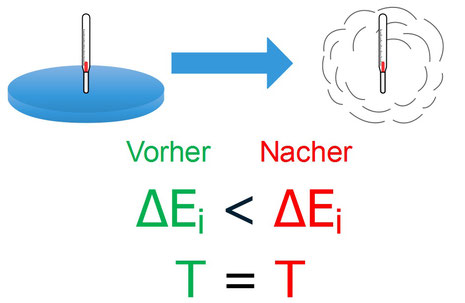
Um eine Flüssigkeit verdampfen zu lassen, muss nicht nur Energie aufgewendet werden, um diese zur Siedetemperatur zu bringen, sondern es ist auch Energie nötig, dass der Stoff den Aggregatzustand ändert.
Verdampft also eine Flüssigkeit, bleibt die Temperatur dabei erst mal gleich, trotzdem steigt die innere Energie, das liegt daran, dass der Verdampfungsvorgang selber Energie benötigt. Die innere Energie eines Stoffs ist bei gleicher Temperatur im Gas-Zustand höher, als im Flüssigen.
Formel zur spezifischen Verdampfungswärme
Die Energie, die nötig ist eine Flüssigkeit verdampfen zu lassen, lässt sich folgendermaßen berechnen:

- ΔEi = Zunahme innerer Energie beim Verdampfen / Energie, welche nötig ist, um eine Flüssigkeit zu verdampfen / Energie, welche frei wird, wenn ein Gas kondensiert
- m = Masse der Flüssigkeit / des Gases
- r = spezifische Verdampfungswärme
Beispiel zur Berechnung der spezifischen Verdampfungswärme
Ihr habt 500g Wasser (r=2257kJ/kg) bereits auf 100°C erwärmt und möchtet es nun verdampfen lassen. Wie viel Energie ist dafür nötig?
Geg.: m=500g; r=2257kJ/kg
Ges.: ΔEi
Lsg.: Achtet auf die richtigen Einheiten und setzt alles in die Formel ein:
ΔEi = m·r = 0,5kg · 2257kJ/kg
=1128,5 kJ ≈ 1,12 MJ
A: Es sind 1,12 MJ notwendig, um die 500g Wasser verdampfen zu lassen.
Spezifische Verdampfungswärme und Siedepunkte
| Stoff | r in kJ/kg | °C |
| Helium | 20 | -269 |
| Wasserstoff | 450 | -252,77 |
| Stickstoff | 199 | -195,8 |
| Argon | 163 | -185,9 |
| Sauerstoff | 213 | -182,97 |
| Ethanol | 854 | 78,3 |
| Benzol | 394 | 80,1 |
| Wasser/Wasserdampf | 2257 | 100 |
| Quecksilber | 285 | 356,58 |
| Zinn | 1754 | 907 |
| Blei | 866 | 1751 |
| Aluminium | 10890 | 2447 |
| Silber | 2350 | 2180 |
| Gold | 1650 | 2707 |
| Kupfer | 4790 | 2595 |
| Nickel | 6480 | 2800 |
| Eisen | 6340 | 2750 |
| Platin | 2290 | 4300 |